听是人类感知大千世界的重要方式之一。但是,世界上有千分之二左右的人天生听不见。科学家发现,一个叫TMC的基因突变是元凶之一。但是,关于分子层面的发病机制一直扑朔迷离。
浙江大学医学院神经科学研究中心的实验室里,体长1毫米左右的秀丽线虫们在培养皿里世代繁衍。康利军教授在偶然中发现,存在TMC基因突变的秀丽线虫,发生了产卵困难。这个独特的细节,帮助科学家进一步揭示人类天生耳聋的发病机制谜团。
相关研究发表于2018年2月7日出版的神经科学领域顶级期刊《神经元》杂志。在研究过程中,康利军团队成功治愈秀丽线虫的产卵困难的同时,为治疗人类的先天性耳聋提供了全新的思路。
毛细胞:将机械振动“翻译”成神经信号

图:毛细胞微观结构图(来源:网络)
在我们感知声音的过程中,位于内耳耳蜗的毛细胞扮演着信号“翻译”的功能,通过毛细胞,声音从机械振动转变为大脑可以识别和处理的神经信号。在此之前,声波引起外耳鼓膜振动,中耳的一组听小骨(人体最小的骨头)如小鼓槌一样,将机械震动信号传送到耳蜗内壁的15000多个毛细胞上。
毛细胞因其细胞膜上有很多纤毛而得名。纤毛与纤毛之间连接着蛋白丝。当振动传来,纤毛摇摆着牵拉蛋白丝,像开门一样打开机械力感受离子通道,激活听毛细胞产生电化学信号,科学家称之为“机械门控”。
之前科学界猜测,TMC基因突变导致的先天性耳聋,是因为纤毛的离子通道发生了变化,以至于毛细胞的机械门控出现障碍,无法感知机械振动。但科学界并没有直接的实验证据。
产卵危机与遗传性耳聋
在秀丽线虫身上,康利军教授团队发现并证实了导致先天性耳聋的另一种可能性。
秀丽线虫是一种生活在土壤中的小虫子,标准体长1毫米,靠吃大肠杆菌生活。它们是深受科学家喜爱的模式生物,三天一代,基因工程操作非常方便,身体透明便于观察。康利军团队剔除了秀丽线虫的TMC基因,他们发现了一个奇特的现象:正常的秀丽线虫发生了产卵困难,大量虫卵滞留在母体内,有的则在母体内直接破壳而出了。
“产卵行为跟机械感受之间可能存在密切的联系,也就是卵到达排卵部位后,可能对相关的神经元和肌肉组织产生挤压作用,”研究人员猜测,如果能在秀丽线虫上破解感受压力的蛋白,或许人类听力的问题可以迎刃而解,“我们首先考虑的是神经元如何感受来自卵的压力。但实验结果却显示,TMC基因控制的是一条恒定的离子通道,并不直接影响压力感受。”
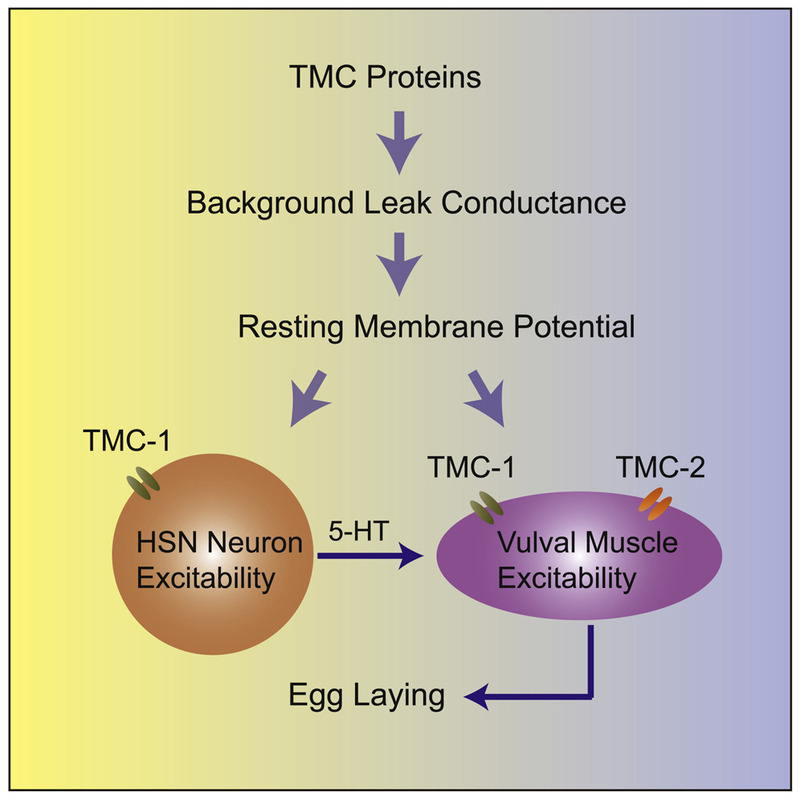
康利军团队获得了和此前科学界的猜测完全不同的结果:
TMC控制的这条离子通道,在正常状态下恒定打开,它让钠离子不断流入细胞,以维持细胞的活性。但当基因发生突变,它表达的离子通道就会关闭,钠离子无法流入,引起细胞超极化,造成细胞功能失活。
TMC基因是位于常染色体上的一个基因,它可以表达8个亚型的蛋白。研究发现,TMC-1在秀丽线虫神经、肌肉系统中表达,而TMC-2特异性表达于肌肉细胞中。 TMC-1和TMC-2的缺失,均会导致秀丽线虫产卵行为缺陷。
“秀丽线虫产卵困难,并不是因为它感受不到来自于卵的压力,而是本身控制产卵的神经和肌肉细胞失活了。”康利军解释,在人、老鼠等哺乳动物身上,TMC基因的突变则表现为家族性耳聋。“这提示我们,TMC基因或许是直接决定着毛细胞的活性,而不是之前猜测的机械门控。”

新的解决方案
另一项有趣的实验中,康利军团队试图让TMC基因突变的小虫恢复产卵能力。
第一种方法,是将健康人类或小鼠的TMC同源基因表达的蛋白过表达在TMC基因突变的秀丽线虫中。让正常的蛋白代替失活的蛋白进行工作,实验结果显示:有效!“这表明,哺乳动物类TMC基因和秀丽线虫TMC具有进化上的保守性和类似功能机制。”康利军说。
第二种方法是直接用药。“既然研究发现,TMC突变是通过细胞超极化导致了细胞兴奋性下降。我们可以去寻找方法逆转超极化。”康利军介绍,一种已知的抗抑郁药物,可以阻断相关细胞的钾离子外流。“‘进口’和‘出口’都堵上,超极化的现象就消失了。”这项实验中,线虫也成功恢复了产卵功能。
科学家研究虫子的最终目的在于人,希望能为早期诊断和治疗遗传性耳聋和其他相关神经肌肉系统疾病提供方案。
清华大学生命科学学院研究员熊巍在接受Bioart学术公众号访谈时说:“康利军组的研究为我们打开了一个了解TMC功能的全新视角,同时提示药物或遗传操作可能用来治疗TMC缺陷造成的遗传性疾病,为TMC相关的遗传性疾病的诊断、治疗和药物研发提供了理论依据和研究模型。”
浙江大学神经生物学博士生岳晓敏、赵剑、硕士生李笑为论文的共同第一作者。浙江大学医学院神经科学研究所研究员康利军博士和弗洛里达大学衰老研究所肖睿博士为本论文的共同通讯作者。该研究工作获得了国家重大科学研究计划、国家863计划、国家自然科学基金和浙江省自然科学基金的资助。
(科学撰稿人:周炜)
论文链接:Yue et al., TMC Proteins Modulate Egg Laying and Membrane Excitability through a Background Leak Conductance in C. elegans. Neuron (2018), https://doi.org/10.1016/j.neuron.2017.12.041

