肿瘤细胞中存在一条古老的信号通路——转化生长因子TGF-β信号通路,它早期抑制癌细胞的生长,晚期促进癌细胞的转移。因此,在癌症的不同阶段,TGF-β信号失活将会将癌症引向截然不同的结果。浙江大学生命科学研究院冯新华实验室最新发现,一种叫ALK的激酶能够通过“改造”TGF-β信号下游的蛋白而导致其信号失活。这是否意味着,现有抗癌药物使用时有可能存在促进癌症转移的风险?
1月21日在Nature Cell Biology (自然•细胞生物学)在线发表的论文ALK phosphorylates SMAD4 on tyrosine to disable TGF-βtumor suppressor functions中,研究团队揭示了这种全新的细胞调控机制,并针对这一现象讨论了癌症治疗的新策略。

SMAD4与TGF-β信号失活
从果蝇到人类,从正常细胞到癌症细胞,绝大多数细胞都会分泌转化生长因子TGF-β,它经过细胞膜表面特定的受体进入细胞,通过一连串效应分子的作用,调控着细胞的生老病死。在癌症细胞中,这条信号通路却是个特别的“两面派”:早期,它是具有抑癌作用的“天使”,而晚期则被证明是能促进癌症转移的“魔鬼”。
自上世纪80年代,TGF-β基因首次被克隆并在大肠杆菌中表达以来,一系列围绕TGF-β信号通路的研究随之展开,SMAD是科学家在这条通路上找到的蛋白家族,其中SMAD4是这个家族的重要成员之一。在SMAD4和同伴蛋白的共同作用下,TGF-β功能才能发挥。
“在胰腺癌和消化道癌细胞中,SMAD4发生了高频率的缺失和突变。”冯新华说,但是,还有很大一部分其它组织的癌症细胞里,其SMAD4基因并没有发生变异或缺失,TGF-β信号为什么也失活了呢?”冯新华说,这个困惑将他们引向了一个意外的发现。
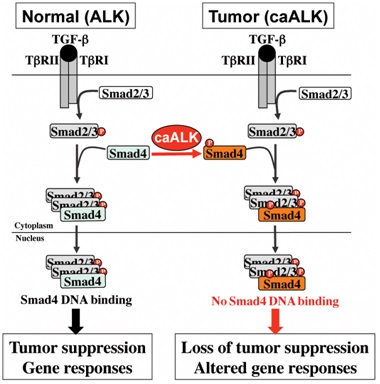
课题组发现,在淋巴瘤、肺癌、神经母细胞瘤等肿瘤中,SMAD4被“改造”了,在一个酪氨酸位点上被磷酸化修饰。“就像一个分子开关被‘关上’了,导致SMAD4无法介导TGF-β信号。”实验室成员顾舒晨老师说。
半路杀出个“ALK”
正常的SMAD4能结合细胞核内的DNA,介导TGF-β信号下游的基因表达。但在部分肿瘤细胞中,SMAD4分子结构上的第95位酪氨酸被磷酸化修饰了。“磷酸化修饰导致SMAD4不能与DNA结合。”实验室另一个成员肖睦说,这就导致了信号“断路”。
课题组发现,间变性淋巴瘤激酶(ALK)发起了这项“改造”。激酶,是细胞一种具有催化效应的蛋白。“我们的研究首次揭示了ALK阳性肿瘤中SMAD4存在酪氨酸磷酸化修饰,这种修饰导致TGF-β信号通路的功能丧失。”冯新华说。“在癌症的早期,TGF-β信号本来是抑制肿瘤生长的‘刹车’,ALK则能把这个‘刹车’关闭。”
长期以来,TGF-β研究领域均未发现SMAD家族蛋白存在酪氨酸位点的磷酸化修饰,该研究为TGF-β信号的调控提出了一种新机制。
抗癌还是促癌?
许多癌症如淋巴瘤、肺癌、神经母细胞瘤中存在ALK的异常激活。于是,目前临床上使用的抗癌药物中,有一部分就是采取了抑制ALK活性的思路。比如,ALK抑制剂目前是治疗ALK阳性非小细胞肺癌的一线靶向药物,该药物治疗其它ALK阳性癌症的临床试验也在进行中。
“如果抑制了ALK,那么ALK对SMAD4的磷酸化修饰也消除了。这样,TGF-β信号通路的响应也就恢复了正常。”冯新华说,这意味着,如果在肿瘤发生的晚期使用ALK抑制剂,就有可能恢复TGF-β信号通路,露出“魔鬼”的一面,存在促进肿瘤转移的可能性。从细胞实验到动物实验到人体病理切片,课题组观察并证实了这种可能性。
冯新华认为,基于TGF-β信号通路还能够调节机体其他许多生理和病理反应,比如免疫抑制、器官纤维化等,“我们的研究提示了ALK抑制剂的潜在副作用。在ALK阳性癌症的靶向治疗中,我们建议采用ALK和TGF-β抑制剂联合用药的策略。”冯新华说。
该研究论文第一作者张倩婷曾获得浙江大学争创优秀博士学位论文资助。此项研究的部分工作获得了国家自然科学基金重大项目和重点项目、科技部国家重大研究计划以及浙江大学基本科研业务费专项资金的支持。
论文链接:https://www.nature.com/articles/s41556-018-0264-3
文 | 周炜
图 | 课题组
编辑 | 周炜
转载请注明出处:浙江大学学术委员会

